鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域ではPb(OH)キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。(a)滴定しようとする金属イオンに対し、鋭敏に変色する金属指示薬のない 場合。 (b)補助キレート剤を用いても、滴定可能なpH限域内で、目的の金属イオン が水酸化物として沈殿し、金属イオンを溶液として保つことが不可能な場合。
2cのページ
キレート滴定 ph 理由
キレート滴定 ph 理由-ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。キレート滴定(キレートてきてい、chelatometric titration )とは、錯滴定の一種で、錯形成試薬としてキレート試薬と呼ばれる多座配位子を用いるもの。 この容量分析法は金属 イオンの迅速で簡単な定量法の1つとして広く用いられている。 主なキレート試薬としてEDTA(エチレンジアミン四酢酸


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ
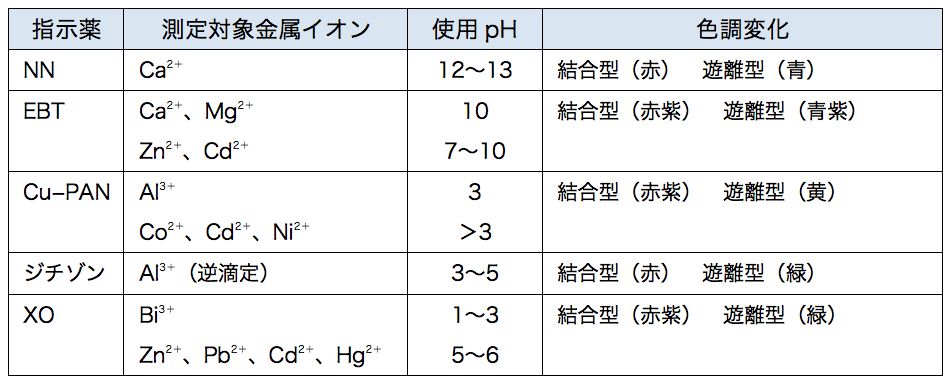
33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に河川や水道の水などのキレート滴定では pH を調節することでカルシウムとマグネシウムを分離して定量するというのが定番ですが (pH > 12 でマグネシウムが水酸化物として沈殿)、ここではあえて分離せず、カルシウム・マグネシウムの合量をカルシウムということで扱うことにしています。キレート滴定に用いられる主な金属指示薬を以下に示す。 金属指示薬については、目的金属イオンとEDTAとのキレート形成に最適なpHで変色する指示薬を選択する必要がある。 3 医薬品の定量 <例:塩化カルシウム水和物(CaCl 2 ・2H 2 O:)の定量>
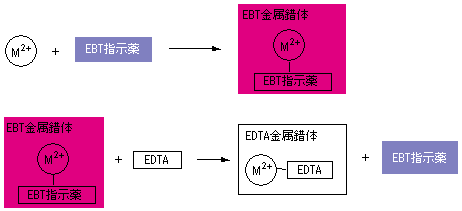
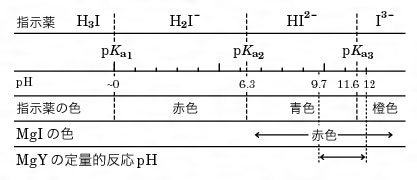
エリオクロムブラックT (EBT )は、分子内にアゾ基、スルホ基などを有する三塩基酸です。 EDTAによるキレート滴定でよく使用される指示薬です。 中性の状態を H3In とすると、pH6以下では 赤色のH2In– 、pH7~11では 青色のHIn2 、pH11以上では 橙色のIn3 が安定です。 Mg 2 、Ca 2 、Zn 2 、Ni 2 などの金属と11で反応し、 赤色のMIn– を形成します。 ( In 金属指示薬、 Hそこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。そこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。
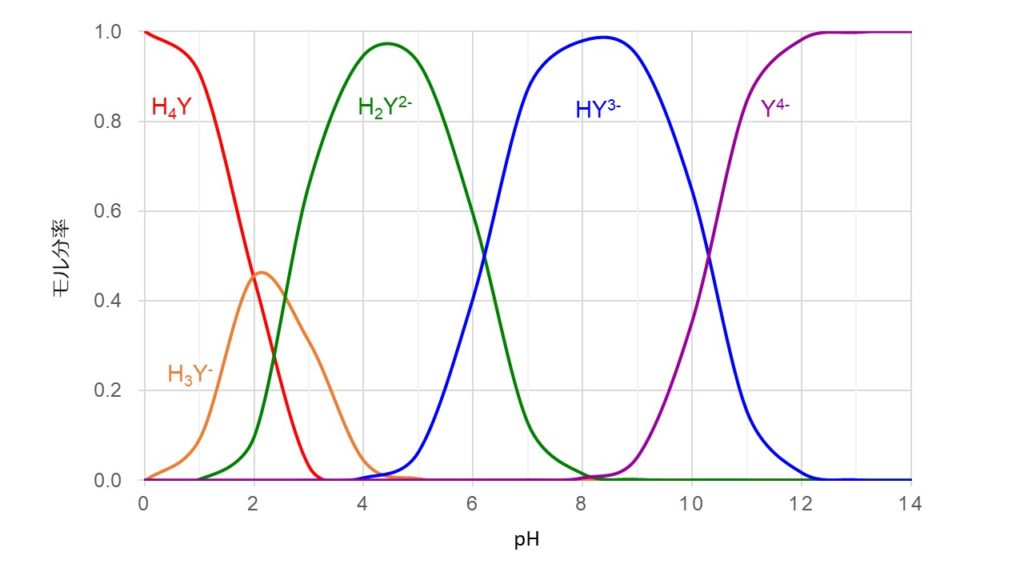
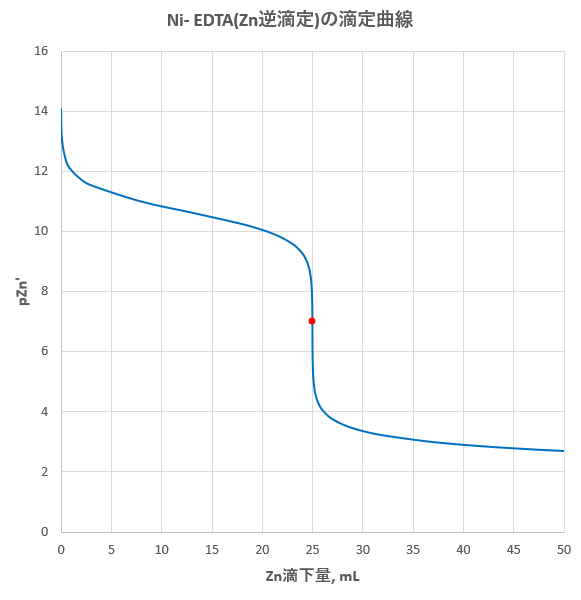
のおこるpHは 金属イオンの種類によって異なり,た と えば,Bi,Thな どでは中性溶液ですでに分解がおこり, またMgな どではpH11以 上で分解がはじまります 以上のことからpHが ひくくなるとHの 濃度増加 のためEDTA錯 塩が不安定になり,pHが 高くなると水キレート滴定では、pH の設定に注意を払う必要がある。 まず EDTA が直接的にキレート生成にかかわるのは四価の負イオンとしてであるが、pH が低くなると四価の負イオンとして溶存する量が減少し、キレート生成が押さえられるようになる。よって、 (1)の結果と合わせると、 Cd 2のキレート滴定の 至適 pH 範囲 は、 40 <pH <78 となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤


年11月発行 カルシウム塩のキレート滴定について
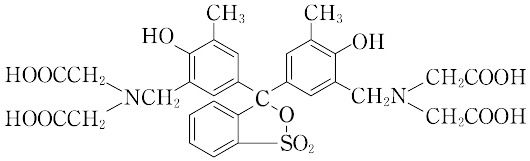


キシレノールオレンジとは コトバンク
<化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。I 3 EDTA 2Na ① &Ø0 (j 001M xEDTA 2Na @A ˜ 150mL È e è / ② à EDTA 2Na @A < >˜ j'(p1 EDTA 2Na @A ˜ / ③ à S˜&j( CaCO 3 01 ˜˘ * / ④ k à S ˇˆ 2mL ˜ø‚Z ˙ > ˝"˛€˚˜W ˜pè $ HCl ˜Iî


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



17 号 キレート剤の定量方法 Astamuse
水酸化カリウム ca –nn指示薬の錯生成能を高めるためのph調整 nn指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) edta溶液 滴定剤 有機廃液タンクへ (注ぎ口にろ紙をつけておくこと!) 実験の注意事項 edta滴下キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。



無料印刷可能 酸化 還元 滴定 考察 画像ブログ
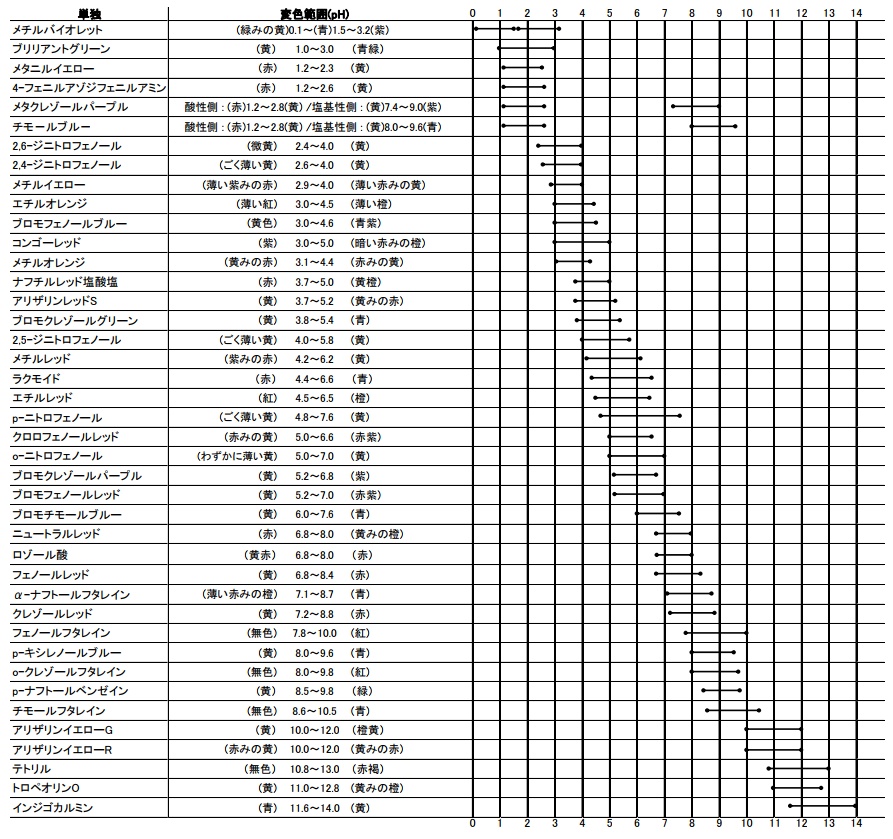


Ph指示薬変色範囲 お問合せ 試薬 富士フイルム和光純薬
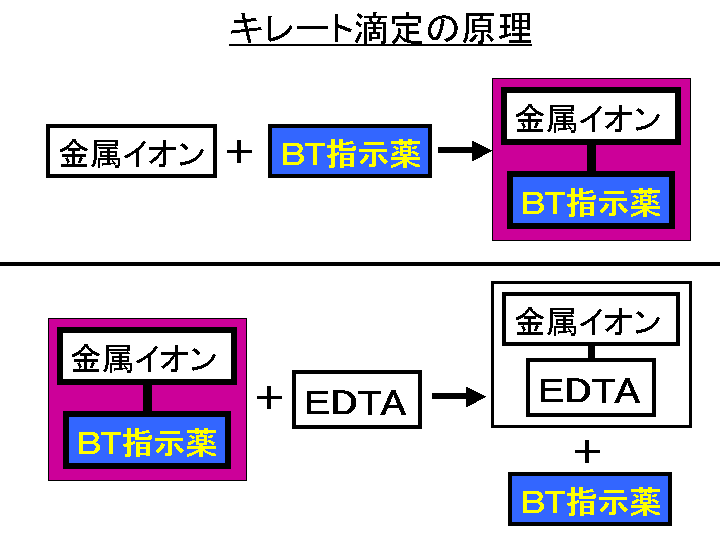
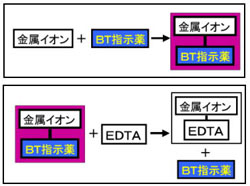
ホールピペットを用いて,Mg 2 を含む試水10 mLを100 mLビーカーに取る. 緩衝液(Na 2 B 4 O 7 ‐Na 2 CO 3, pH 10) 2 mLをメートルグラスで測り取り,加える.<化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理(2) edta滴定の終点での変色の原理、phを変えると各種イオンが定量できる原理 nn、btは最初caやmgと錯生成していて、金属に配位した状態だと赤を示す。 edtaを加えるとキレート効果で置換されるためnn、btは遊離して青を示す。
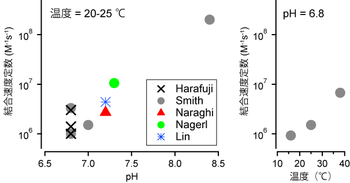


カルシウムキレート剤 脳科学辞典



17 号 キレート剤の定量方法 Astamuse
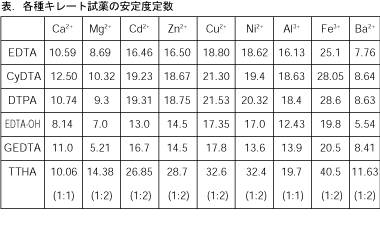
キレート滴定法の原理 表1金属‐edtaキレート 表1酸解離定数 表2キレート安定度定数 表3 ph領域および指示薬キレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。キレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラル


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ



当量点の求め方 滴定曲線からの当量点の求め方がよく分かりません 化学 教えて Goo
鉄イオンなどは、pHが2程度の酸性溶液でキレート滴定します。 これは、pHが高くなると、水和している鉄イオンがオール化してキレート反応しにくくなるからです。 オール化とは、鉄イオンに配位結合している水分子から水素イオンがとれて OH になり、この鉄イオンについた OH がもう一つの鉄イオンについている OH と結合して安定な多核体を作るからです。 上野ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。
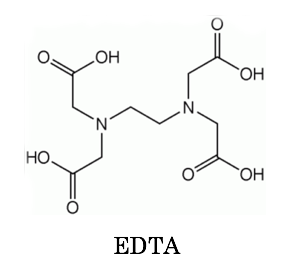


キレート滴定 Yakugaku Lab



書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学
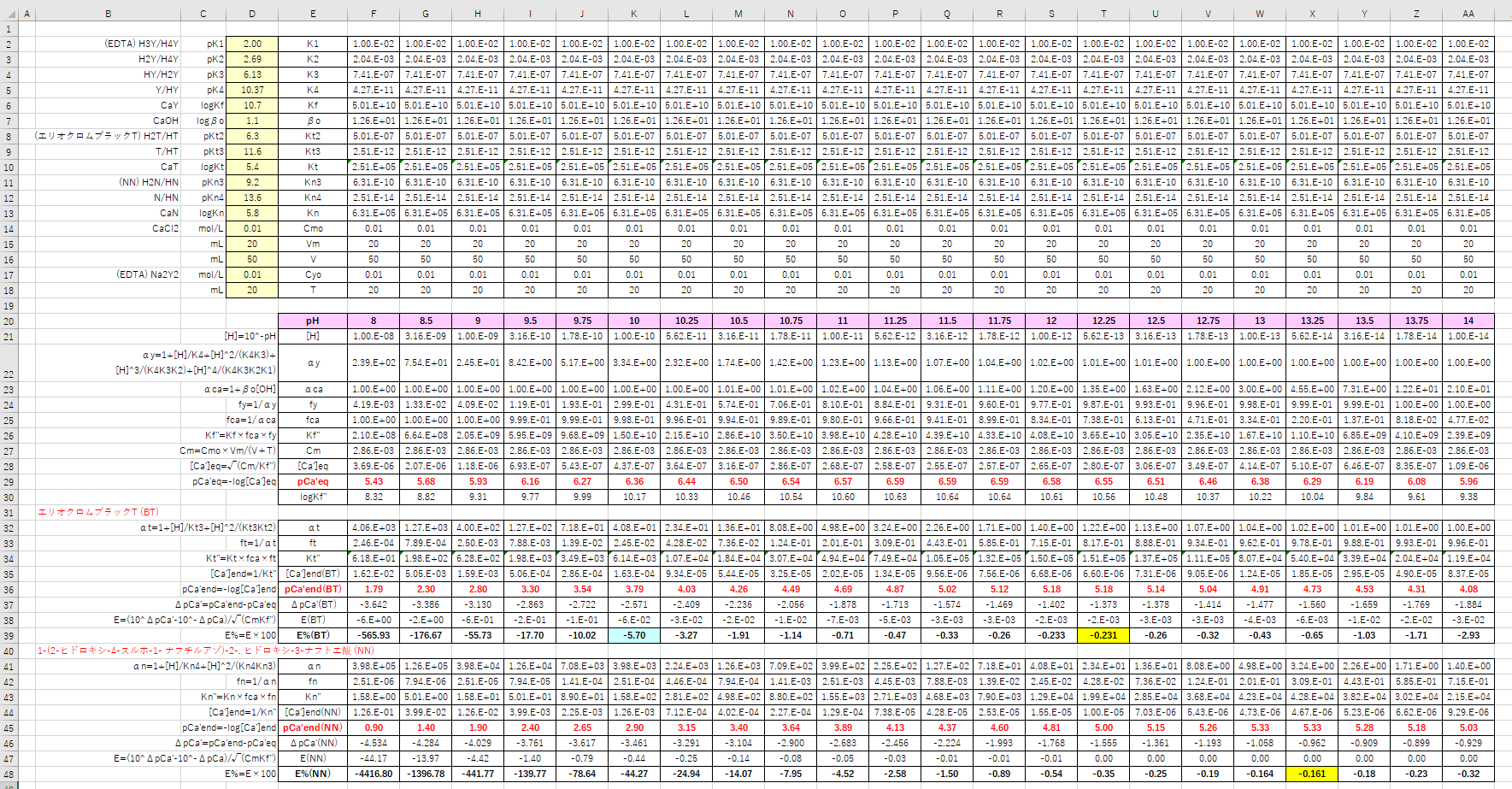


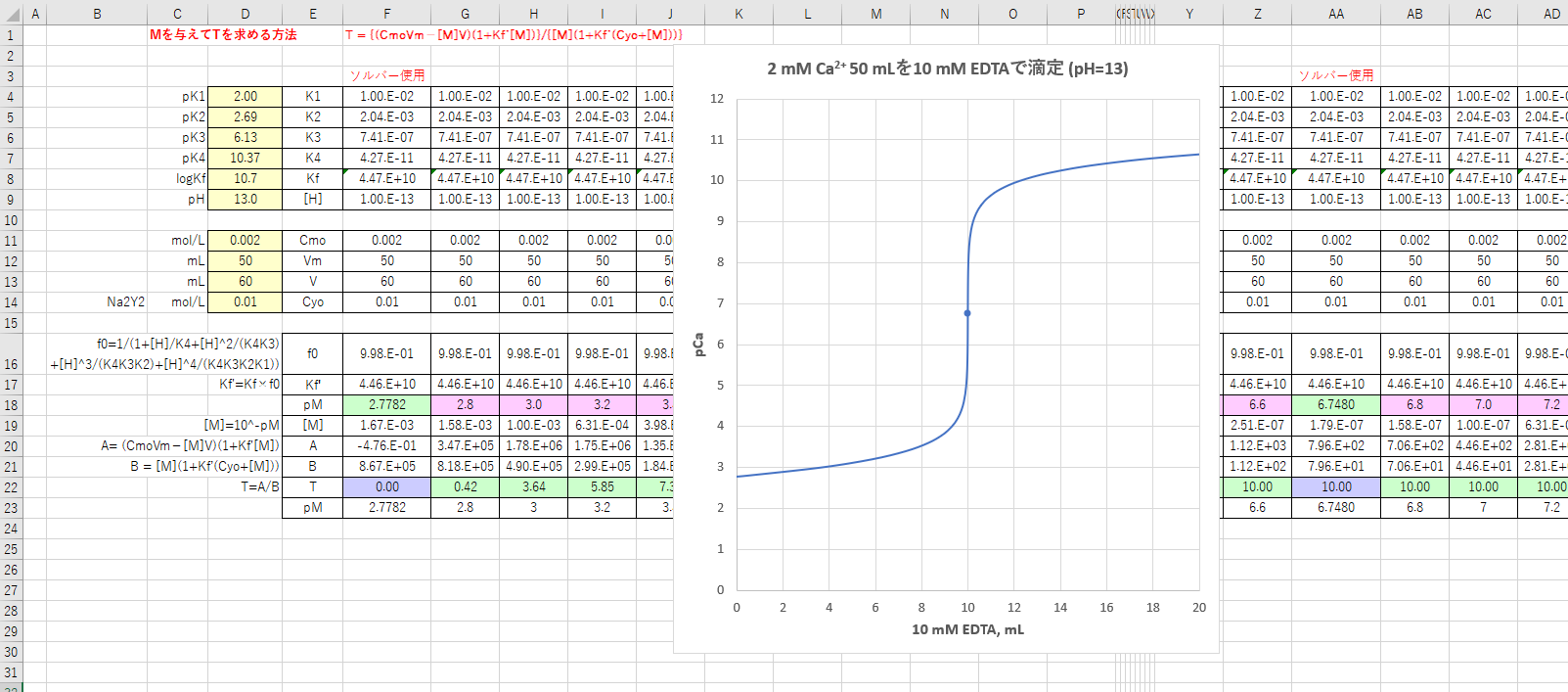
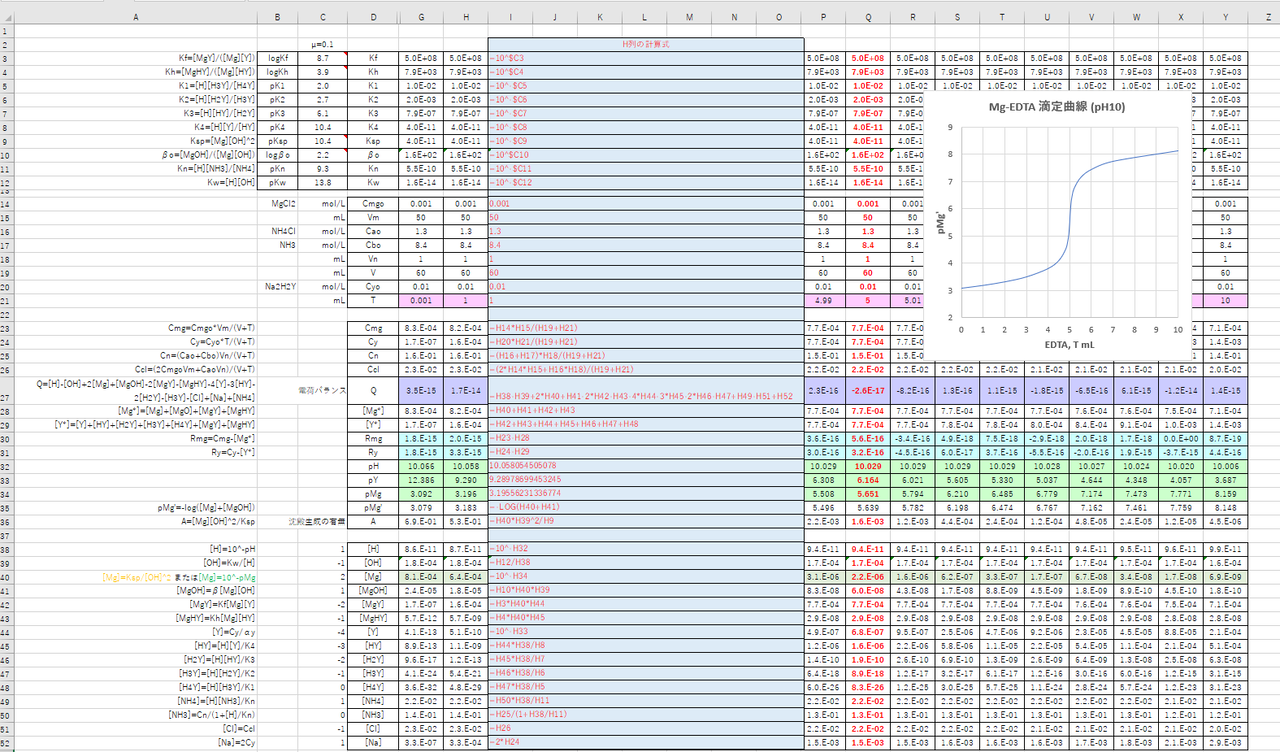
Edta 滴定曲線 溶解度などーエクセルを用いて



キレート滴定


無料印刷可能 酸化 還元 滴定 考察 画像ブログ
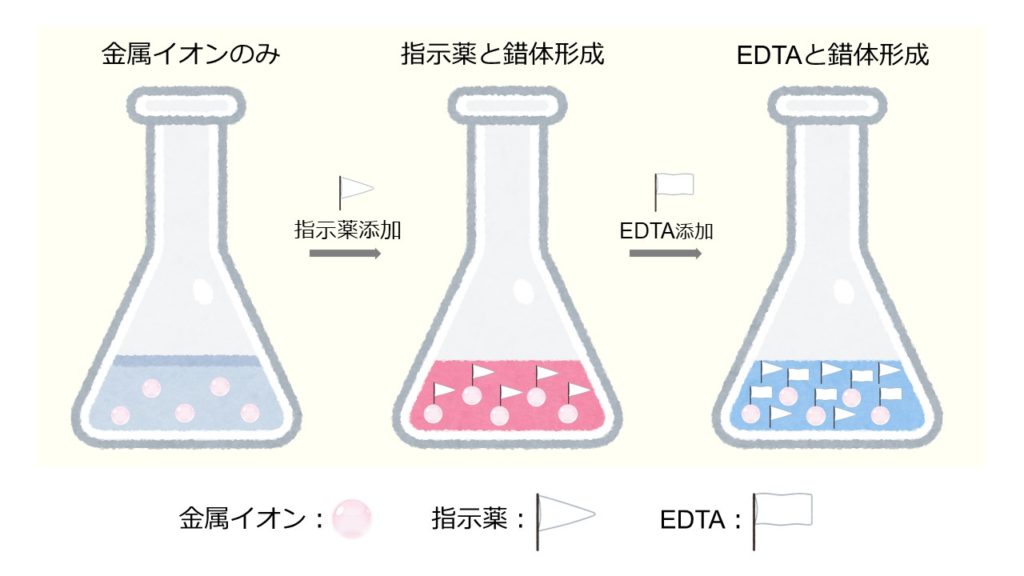


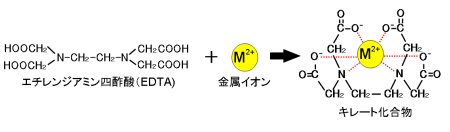
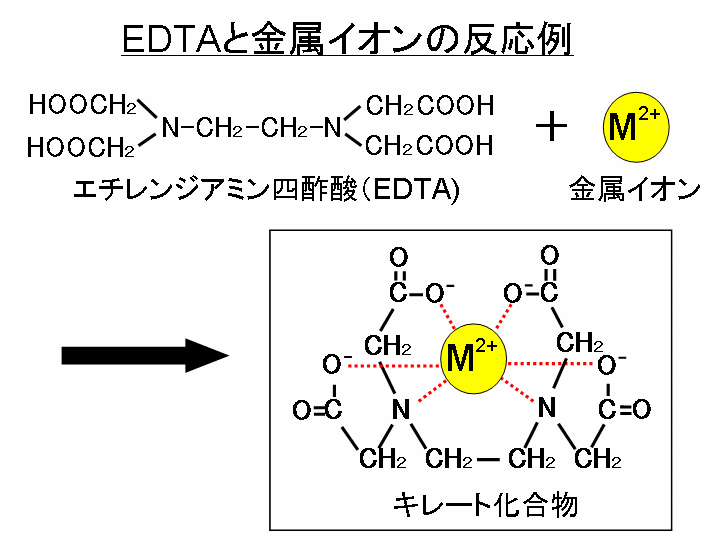
エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
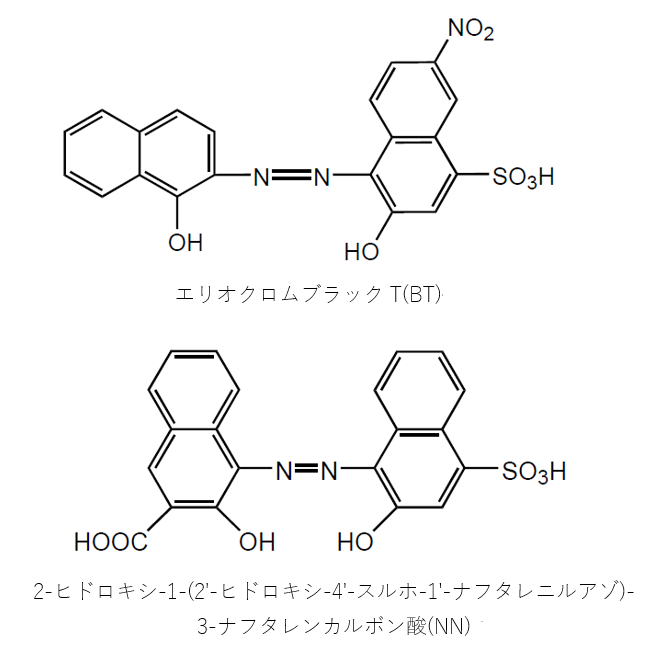


Edta 滴定曲線 溶解度などーエクセルを用いて


Column


水の硬度測定 キレート滴定



比色試薬 金属指示薬 Nn 同仁化学研究所


水の硬度測定 キレート滴定



京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


キレート滴定 Yakugaku Lab


カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


水の硬度測定 キレート滴定


キリヤ Q A



比色試薬 金属指示薬 Xo 同仁化学研究所


キリヤ Q A


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


キレート滴定行ったのですが 緩衝溶液を入れる理由が分かりません Phの変化 Yahoo 知恵袋



Ii 機能編 1 金属イオン結合性 コスモ バイオ株式会社


キレート滴定曲線 Androidアプリ Applion
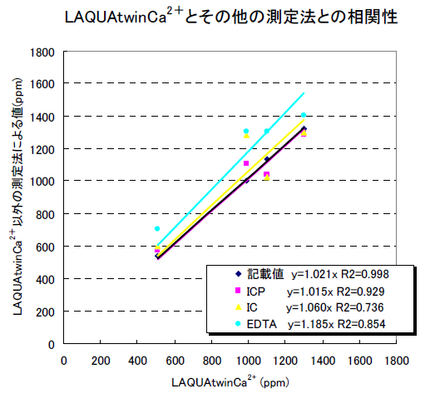


Laquatwinによる牛乳及び乳飲料中のカルシウム測定 Laqua 水質計測総合サイト Horiba


第24章 滴定曲線



17 号 キレート剤の定量方法 Astamuse


水の分析


水の硬度測定



キレート滴定 Japaneseclass Jp


Edta 滴定曲線 溶解度などーエクセルを用いて


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


水の硬度測定 キレート滴定


Edta 滴定曲線 溶解度などーエクセルを用いて
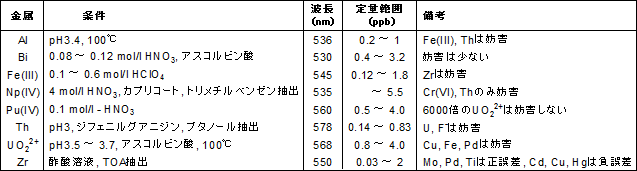


比色試薬 金属指示薬 Xo 同仁化学研究所



高校化学 中和滴定の滴定曲線について 高校2年生です ある参考書に 化学 教えて Goo
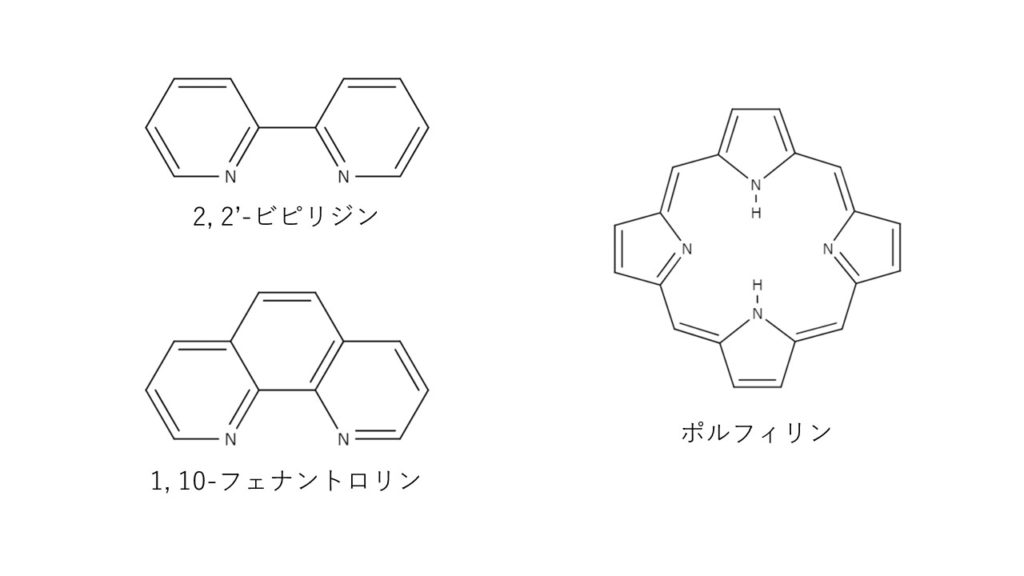


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋
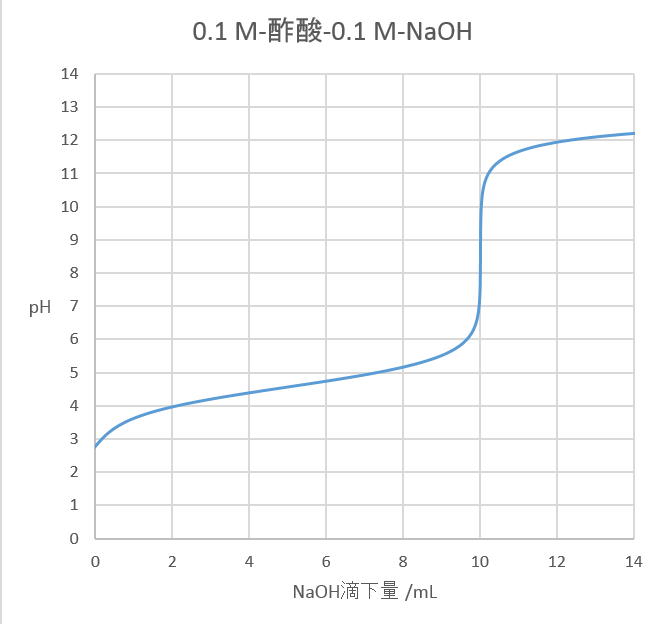


滴定曲線の理論値をexcelで書く



指示薬 とは 意味 エキサイト辞書


キレート滴定 Japaneseclass Jp


質問箱
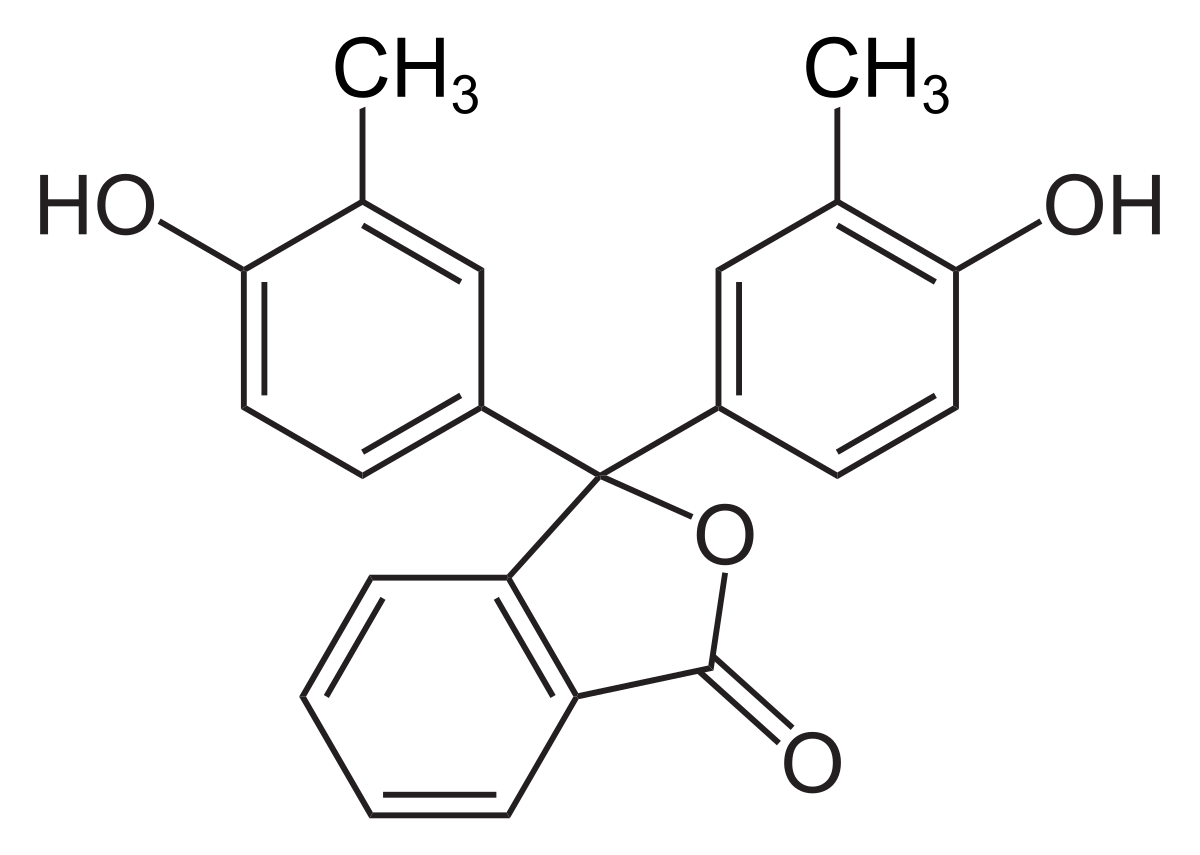


クレゾールフタレイン Wikipedia
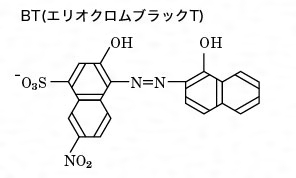


キレート滴定とは コトバンク


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
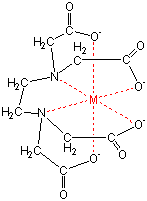


水の硬度測定
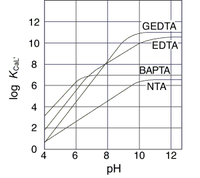


カルシウムキレート剤 脳科学辞典



キレート滴定 Yakugaku Lab


2cのページ



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


化学 中和滴定 技術情報館 Sekigin 酸塩基滴定 中和滴定 の概要紹介 滴定曲線 滴定の基本操作 基本用語について紹介



キレート滴定



アプリの紹介 キレート滴定曲線 車輪の再発見みたいな



比色試薬 金属指示薬 Bt 同仁化学研究所
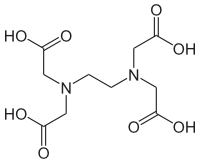


カルシウムキレート剤 脳科学辞典



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



日本薬局方 一般試験法 2 50 滴定終点検出法 Speaker Deck



アプリの紹介 酸 塩基中和滴定曲線pro 車輪の再発見みたいな


キレート滴定とは コトバンク


ジンコンとは コトバンク



0 件のコメント:
コメントを投稿